Was ist ein QMS?
Ein Qualitätsmanagementsystem (QMS) ist ein Steuerungssystem für ein geplantes und systematisches Vorgehen zur Erhaltung bzw. Verbesserung der Qualität. Ein QMS besteht aus Prozessen, Richtlinien und Vorlagen, welche das standardisierte Vorgehen beschreiben, damit vergleichbare Qualität der Arbeitsresultate erreicht wird. Dadurch werden Fehler vermieden, statt sie am Ende des Arbeitsprozesses teuer zu beseitigen.
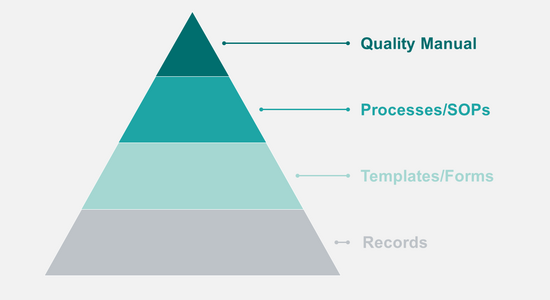
Ein QMS besteht aus unterschiedlichen Dokumententypen:
- Quality Manual: Beschreibung der Organisation und Übersicht aller Prozesse
- SOPs: Arbeitsprozesse und Verantwortlichkeiten
- Vorlagen: Formulare und Dokumentenvorlagen für die Erfassung von Daten und Berichten
- Aufzeichnungen: Daten, Berichte, Belege
Warum brauchen klinische Studien ein QMS?
In der klinischen Forschung haben wir die gesetzliche Verpflichtung, nachvollziehbare Daten zu erheben und reproduzierbare Resultate zu erarbeiten. Zusätzlich tragen wir den teilnehmenden Patientinnen und Patienten gegenüber eine besondere Verantwortung. Die Garantie von Würde, Persönlichkeit und Gesundheit der Studienteilnehmenden gehört zu den obersten Prinzipien, denen Forschende und alle ihre Mitarbeitenden verpflichtet sind.
Ein QMS hilft dabei, die folgenden Ziele zu erreichen:
- Sicherheit & Schutz der Studienteilnehmer gewährleisten
- Qualität der Studiendaten sichern
- Übersicht und Transparenz über die Studienaktivitäten schaffen
- Nötige Dokumentation erstellen
- Effizienz bei der Studiendurchführung steigern
- Einhaltung von ICH-GCP, lokalen und internationalen Gesetzen garantieren
- Fit für (Swissmedic-) Inspektionen zu sein
Gesetzliche Vorgaben
Das Schweizerische Humanforschungsgesetz (HFG) und die Verordnung über klinische Versuche in der Humanforschung (KlinV) schreiben vor, dass klinische Studien gemäss den Internationalen Richtlinien von Good Clinical Practice durchgeführt werden müssen. Verantwortlich dafür ist der Sponsor der Studie. In Investigator-initiated Trials (IIT) im akademischen Umfeld ist das der Sponsor-Investigator, meistens also der Forschungsgruppenleiter bzw. Die Forschungsgruppenleiterin. Das QMS ist das Werkzeug, um nachweisen zu können, dass die gesetzlichen Vorgaben von der Studie erfüllt werden.

